10일 식품의약품안전처는 코로나19 백신 ‘한국아스트라제네카코비드-19백신주’에 대해 추가 임상시험 결과 등을 제출하는 조건으로 허가를 결정했다고 밝혔다.

이로써 국내에서 첫 번째로 사용허가가 난 코로나19 백신은 아스트라제네카 코로나19 백신이 주인공이 됐다. ‘한국아스트라제네카코비드-19백신주’는 코로나19 바이러스 표면항원 유전자를 침팬지에게만 감염되는 ‘아데노바이러스’에 넣어 배양 생산한 후 사람 세포 안으로 전달하는 바이러스벡터 백신으로 알려져 있다.
전달된 코로나 항원 유전자는 체내에서 항원 단백질을 합성해 중화항체의 생성을 유도하게 되며, 코로나19 바이러스가 인체에 침입했을 때 바이러스를 중화해 제거하게 된다. 이 약의 효능‧효과는 18세 이상에서 코로나19(COVID-19)의 예방이며, 용법‧용량은 0.5 mL씩 4~12주 이내에 2회 근육주사하는 것이다.
‘한국아스트라제네카코비드-19백신주’는 한국아스트라제네카가 국내 제약사인 SK바이오사이언스에 위탁하여 제조하는 제품으로 국내에서 처음으로 허가받는 코로나19 백신이며 유럽(EMA), 영국 등 50개국가에서 조건부 허가 또는 긴급사용승인을 받았다.
최종점검위원회는 식약처 심사결과와 앞서 실시된 두 차례의 자문 내용 등을 종합적으로 점검했고, 중앙약사심의위원회의 자문의견을 존중하여 ‘한국아스트라제네카코비드-19백신주’에 대해 기존에 제출한 임상자료 이외 미국 등에서 진행 중인 3상 임상시험 결과 등을 허가 후 제출하는 조건으로 품목 허가하는 것으로 결정했다.
이는 임상시험을 비롯해 비임상시험, 품질, 위해성관리계획, 제조‧품질관리 등 허가심사에 필요한 자료에 대해 각 분야의 심층적인 심사와 현장조사 결과 등을 종합적으로 검토한 결과, 안전성과 효과성을 인정한 것에 따른 것이다.
최종점검위원회는 안전성과 관련해, 보고된 이상사례는 대부분 백신 투여와 관련된 예측된 이상사례로 전반적으로 양호하다고 판단했다.
BEST 뉴스
-

김건희 ‘판도라 폰’ 공개되자… 도이치 공범 이준수 추적, 행방 묘연
김건희 여사의 휴대전화 포렌식 자료가 공개되면서 도이치모터스 주가조작 사건의 ‘숨은 인물’로 지목돼온 56세 이준수 씨의 실체가 다시 주목받고 있다. 윤석열 전 대통령 부인 김건희 여사가 8월12일 구속 전 피의자 심문(영장실질심사)을 받기 위해 서울 서초구 서울중앙지법에 출석하고 있다. 사... -
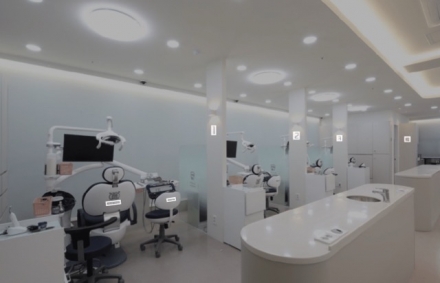
강남 똑똑플란트치과, 결국 터질게 터졌다 …노동부 특별감독 착수
서울 강남구 대형 임플란트 전문 치과인 똑똑플란트치과에서 수년간 비정상적인 근로 관행과 직장 내 괴롭힘이 벌어졌다는 의혹이 확산되며 고용노동부가 특별근로감독에 착수했다. 이번 사안은 입사 이틀 만에 퇴사한 직원에게 180만원을 배상하라는 내용증명이 발송되면서 시작됐다. 해당 사실이 온라... -

'반성문 강요·3시간 대기·사후관리 실종'…논란 확산하는 똑똑플란트치과
강남의 한 치과를 둘러싼 논란이 점차 확산 일로를 걷고 있다. 직원들에게 수백 줄짜리 반성문 작성, 면벽 서기, 고성·욕설이 반복됐다는 내부 제보가 불거져 고용노동부가 특별근로감독에 착수한 데 이어, 이번에는 환자들의 시술 불편·사후관리 부재·비용 논란이 잇따라 제기되며 파문이 다시 커지고 있다. ... -

“시대인재” 저작권 무단 사용…문저협 가처분·형사 고소 강행
국내 최대 문학·예술 저작권 관리 단체인 한국문학예술저작권협회(문저협)가 대치동 대형 입시학원 ‘시대인재’를 상대로 저작권 침해금지 가처분을 신청하고 형사 고소 절차에 들어갔다. '교육 목적을 명분으로 참고서·문학 지문을 무단 발췌하고 출처를 누락하는 사교육 시장 관행을 더는 ... -

‘매우 혼잡’ 대한항공 라운지…아시아나 승객까지 쓴다고?
#. 16일 대한항공 비즈니스석을 타고 인천에서 시드니로 떠난 대한항공 고객은 이날 대한항공 앱에서 2터미널 라운지 혼잡 정도를 검색했다가 깜짝 놀랐다. 2터미널에 있는 3개의 대한항공 라운지가 전부 빨간색으로 표기되며 ‘매우 혼잡’이라고 경고하고 있었기 때문이다. 지난 8월 새롭게 연 ... -

장경태 ‘성추행 공작’ 논란…모자이크 해제 영상 공개되며 공방 격화
더불어민주당 장경태 의원을 둘러싼 이른바 ‘성추행 의혹 영상’ 파문이 새로운 국면을 맞고 있다. 최근 온라인을 통해 모자이크 처리되지 않은 원본 영상이 추가로 공개되면서, 사건의 실체를 둘러싼 공방이 한층 뜨거워지고 있다. 문제가 된 영상은 약 1년 전 촬영된 술자리 장면으로, 일부 언론과 온라인 커뮤니티...

![[단독] 대웅제약 ‘에너씨슬 집중샷’, 수험생 불안 팔아 공격적 마케팅…과연?](/data/news/202511/news_1762875958.1.jpg)











![[이상헌의 성공창업경제학] 폐업 소상공인 지원정책의 전환점](/data/news/202511/news_1764322042.1.jpg)




